Monitoraggio reazioni eterogenee online tramite NMR da banco – Transesterificazione dell’estere arilboronico di Pinacol
Gli spettrometri NMR da banco acquisiscono sempre più visibilità grazie alla versatilità analitica e alle possibilità di eseguire svariate applicazioni. Molto diffuso è il monitoraggio delle reazioni, in quanto è possibile e ottenere feedback in tempo reale sullo stato di avanzamento, osservare intermedi di breve durata o rilevare altri cambiamenti fisici e chimici nella miscela.

Ci sono già molti articoli nel nostro blog riguardanti la possibilità di monitorare reazioni in tempo reale su miscele omogenee. Tuttavia, a seconda della reazione chimica specifica, la miscela può variare e risultare più eterogenea con la conseguente presenza di precipitazioni o liquidi immiscibili. Il monitoraggio di miscele eterogenee con NMR è più difficoltoso a causa della presenza di particelle solide nei campioni, che causano perdita di risoluzione spettrale e possibile ostruzione delle linee di trasferimento. Queste condizioni possono ostacolare il processo di campionamento e persino causare problemi di sicurezza.
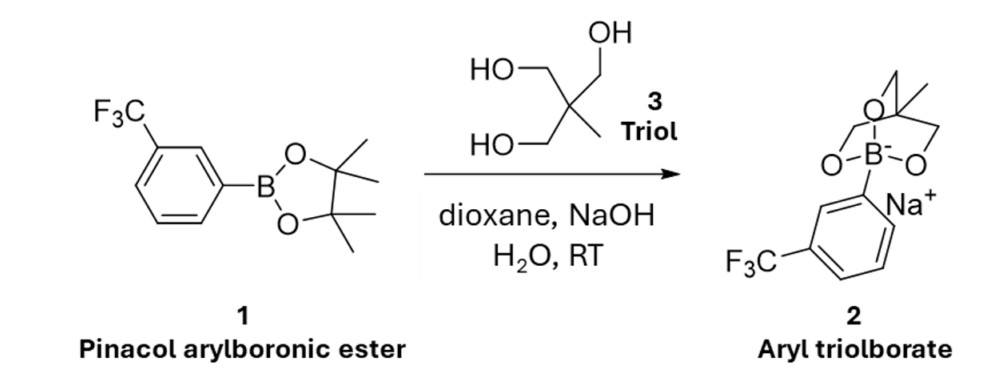
Con l’NMR da banco Spinsolve di Magritek è possibile determinare quantitativamente e in tempo reale il precipitato che si forma durante una reazione chimica. Per evitare che i solidi entrino nelle linee di trasferimento e nel sensore NMR è importante utilizzare adeguati filtri in ingresso o in linea. La reazione selezionata per questo studio è la reazione di transesterificazione di un estere arilboronico pinacolico (Figura 1), che può essere monitorata simultaneamente da NMR 1H e 19F. E’ stato inserito un filtro da HPLC in ingresso al solvente per impedire ai solidi di entrare nel sistema di trasferimento del campione e nella cella di flusso.
Configurazione strumentale
a reazione è stata eseguita seguendo la procedura descritta nell’articolo: Direct Conversion of Pinacol Arylboronic Esters to Aryl Triolborates – Gao-Qiang Li, Shunsuke Kiyomura, Yasunori Yamamoto, Norio Miyaura, Direct Conversion of Pinacol Arylboronic Esters to Aryl Triolborates, Chemistry Letters, Volume 40, Issue 7, July 2011, Pages 702–704.
Il sistema in flusso è stato collegato con il kit di monitoraggio della reazione SpinsolveTM, che prevede la presenza di una cella in flusso in vetro e una pompa peristaltica collegata al vessel di reazione a circuito chiuso. Il tubo di ingresso all’interno del vessel di reazione è stato dotato di un filtro; nel recipiente di reazione, una soluzione di estere arilboronico di pinacolico (1, 200 mM), 1,1,1-tris(idrossimetil)etano (3, 200 mM), NaOH (200 mM) in una miscela di 1,4-diossano normale (protonato) (80 mL) e acqua (0,85 mL) è stata agitata a temperatura ambiente. La miscela di reazione è stata fatta circolare continuamente attraverso lo strumento con una portata di 0,6 mL/min e monitorata per 24 ore. L’uso di solventi normali diossano e acqua richiede un’efficace soppressione dei picchi di solvente per una quantificazione accurata degli analiti. I dati 1H unidimensionali con soppressione del solvente WET e 1D 19F sono stati raccolti simultaneamente e analizzati facilmente con l’interfaccia RMX nel software Spinsolve. Ogni spettro 1D 1H è stato acquisito in 14 secondi, mentre ogni spettro 1D 19F è stato acquisito in 10 secondi.
Come è possibile vedere nella Fig. 2, all’inizio della reazione (sinistra), tutti i reattivi di partenza si sono sciolti completamente, dando origine a una miscela limpida e omogenea. Verso la fine della reazione, era presente un precipitato solido bianco nel pallone di reazione. Non è stata osservata alcuna ostruzione nella linea di trasferimento e nessuna perdita di risoluzione, indice del fatto che il filtro del solvente in ingresso era sufficiente per impedire a qualsiasi particella di entrare nella linea di trasferimento e, successivamente, nella cella di flusso in vetro.

Risultati NMR
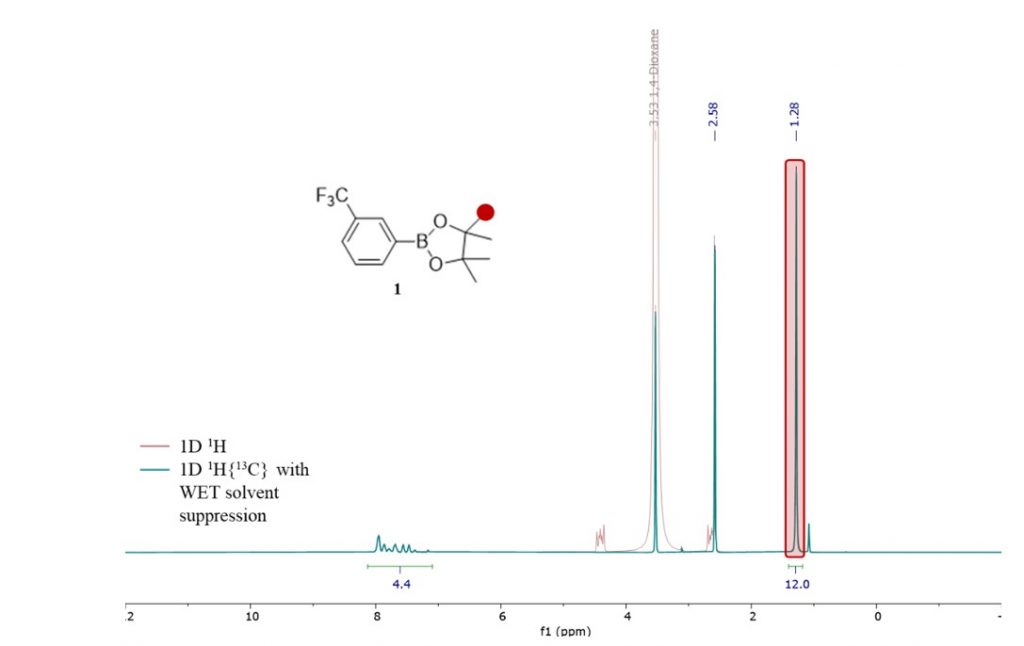
Gli spettri 1D 1H dell’estere arilboronico pinacolo 1 in 1,4-diossano/acqua con e senza soppressione del solvente sono mostrati nella Figura 3. La soppressione del solvente WET è stata implementata insieme al disaccoppiamento 13C per attenuare il segnale 1,4-diossano e far collassare i suoi satelliti 13C per fornire una linea di base pulita in questa regione. Il singoletto a 1,28 ppm corrisponde ai 4 gruppi metilici del composto 1.
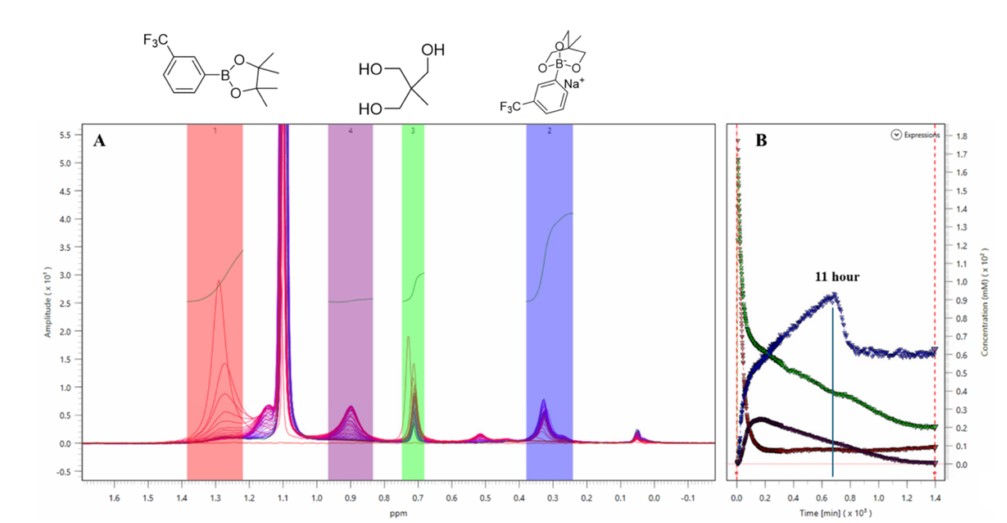
La figura 4A mostra la sovrapposizione di 500 spettri 1D 1H con soppressione del solvente WET nella regione tra 1,7 e -0,2 ppm. Questa regione ristretta è composta da segnali di gruppi metilici in specie diverse, dai reagenti di partenza, agli intermedi e quindi ai prodotti finali che vengono risolti in modo pulito per consentire il monitoraggio simultaneo di questi composti. I valori integrali di diversi segnali sono stati convertiti in concentrazione (mM) nel grafico concentrazione vs. tempo (Fig. 4B) tramite un fattore di calibrazione determinato prima dell’inizio della reazione.
La concentrazione dell’estere arilboronico pinacolico 1 (rosso) è diminuita rapidamente, mentre la concentrazione dell’altro reagente di partenza, il triolo 3 (verde), ha mostrato una velocità di diminuzione più lenta. Si può osservare un intermedio (viola) in cui la concentrazione è aumentata durante le prime 3 ore della reazione prima di diminuire durante il resto del processo.
B) Grafico concentrazione vs. tempo.
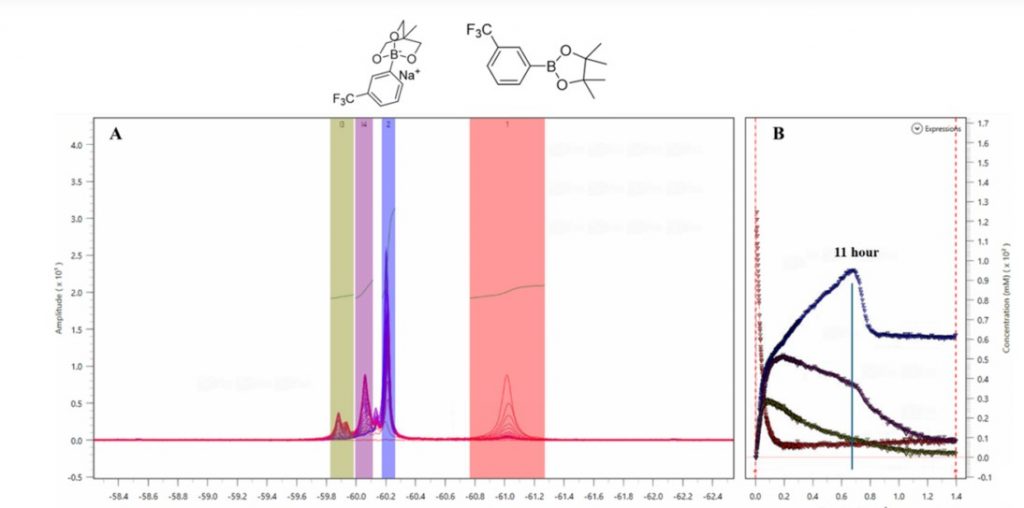
Il prodotto finale, l’aril triolborato 2 (blu), mostra un interessante profilo cinetico. La sua concentrazione aumenta costantemente fino a quando la reazione non raggiunge il limite delle 11 ore. È stato osservato un brusco calo della concentrazione da 95 mM a 60 mM, e si stabilizza a questa concentrazione per il resto del processo di reazione. Al limite delle 11 ore, un solido bianco inizia ad apparire nel pallone di reazione quando l’aril triolborato 2 inizia a diminuire la sua concentrazione nella miscela di reazione. Mentre la concentrazione del prodotto 2 rimane costante per il resto della reazione, le concentrazioni di triolo 3 (verde) e dell’intermedio (viola) continuano a diminuire. Ciò suggerisce che la concentrazione del prodotto 2 raggiunge un equilibrio in cui la velocità di precipitazione è la stessa della velocità di produzione.
B) Grafico concentrazione vs. tempo
I dati 1D 19F mostrano un andamento simile osservato con i dati 1D 1H. Il reagente di partenza 1 può essere seguito dal segnale a -61 ppm. Il segnale del prodotto finale aril triolborato 2 (blu) appare a -60,2 ppm, con lo stesso profilo cinetico dei dati 1D 1H in cui si osserva un brusco calo della concentrazione all’undicesima ora della reazione. Gli altri segnali negli spettri corrispondono a diversi intermedi, che vengono prodotti all’inizio della reazione ma poi utilizzati verso la fine del processo.
Conclusione
Nel complesso, il monitoraggio della sintesi di un aril triolborato con una NMR da banco Spinsolve fornisce una ricca panoramica del meccanismo della reazione. Sono stati osservati più intermedi sia negli spettri 1H che 19F con ottima risoluzione e quantificazione affidabile. Ciò suggerisce che la reazione procede attraverso un meccanismo complesso che coinvolge fasi intermedie con diverse proprietà cinetiche. Il monitoraggio di un processo con NMR consente la determinazione di diversi eventi riguardanti l’aspetto fisico della miscela di reazione. In questa reazione, la precipitazione del prodotto finale si riflette nel suo cambiamento di concentrazione. Infine, questo esempio evidenzia anche il campionamento riuscito di una reazione eterogenea mediante l’introduzione di un filtro in ingresso. La reazione è stata monitorata per 24 ore senza alcuna ostruzione per fornire dati NMR affidabili e di alta qualità.