Determinazione della clorofilla mediante spettrofotometria UV-Vis
Determinazione della clorofilla come indicatore per il monitoraggio della crescita di fitoplancton e cianobatteri nelle acque superficiali, mediante spettrofotometria UV/Vis secondo la norma DIN 38409-60
L’analisi della clorofilla
Tramite l’analisi della clorofilla è possibile determinare la quantità di clorofilla presente in un campione vegetale. Quale funzione ha la clorofilla? Essa è essenziale per la crescita e la sopravvivenza delle piante. Tra le tecniche utile per analizzarla, vi è la spettrofotometria.
La spettrofotometria UV-Vis (ultravioletto-visibile) è una tecnica di analisi chimica che utilizza la luce ultravioletta (UV) per determinare la concentrazione di una sostanza chimica in una soluzione. La spettrofotometria UV-Vis è una tecnologia ampiamente utilizzata nell’analisi della qualità dell’acqua. Questa tecnica, oltre per parametri standard come fosforo, ammonio e nitrato è particolarmente utile nella determinazione di pigmenti vegetali e fotosintentici come clorofille, ficobiline e xantofile.

Determinazione della clorofilla in acqua
Per esempio il grado di eutrofizzazione (ovvero la quantità di nutrienti presenti in acqua, come il fosforo o l’azoto) viene monitorato mediante la determinazione della clorofilla in spettrofotometria, come indicato nella DIN 38409-60 “Determinazione spettrometrica della clorofilla in acqua”. Il grado di eutrofizzazione è strettamente correlato alla crescita di fitoplancton e cianobatteri.
La concentrazione di clorofilla insieme ad altri parametri di bioattività influenza le prestazioni metaboliche del fitoplancton (cianobatteri) negli ambienti acquatici ed è quindi importante l’acquisizione di alcuni parametri per ottenere informazioni sulla crescita di questi organismi. Oltre alla determinazione della clorofilla infatti, viene analizzata la concentrazione di feofitina.
La spettrofotometria UV-Vis, grazie ad assorbimenti specifici, permette di determinare in modo semplice ed affidabile sia la clorofilla che i pigmenti fotosintetici come le molecole di ficobilina, clorofilla b e β-caroteni (Figura 1). Tutto questo è possibile grazie ad uno spettrofotometro a doppio raggio, un sistema semplice, funzionale e automatico per le determinazioni dei pigmenti.
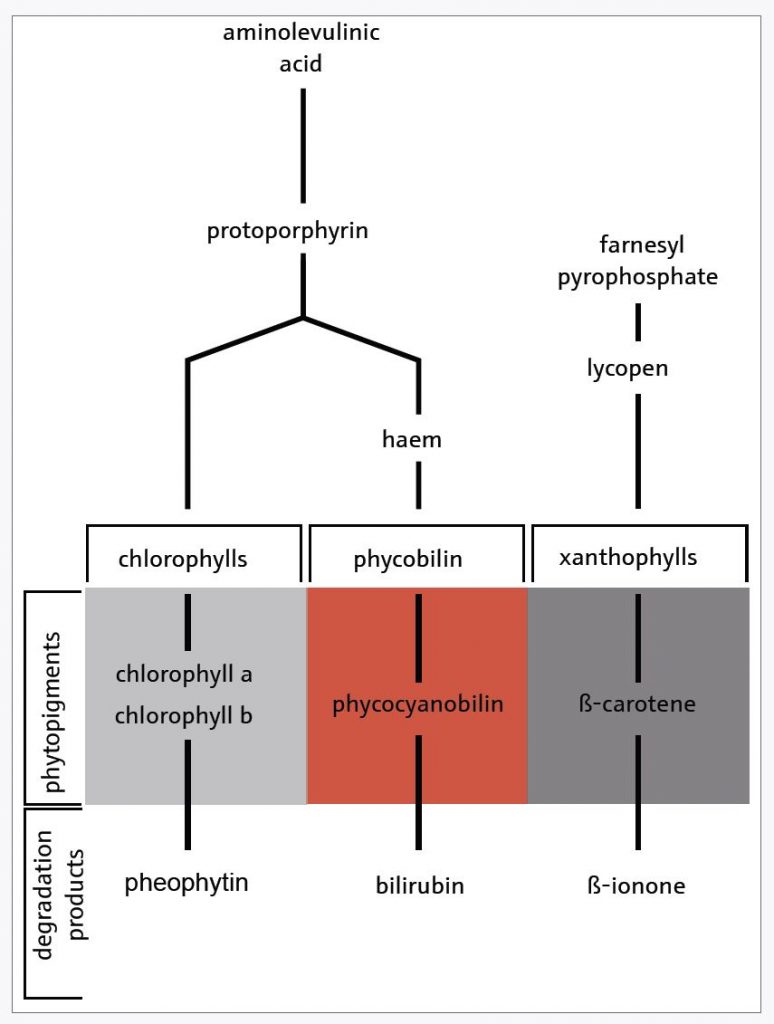
Determinazione su acque superficiali
Sono stati raccolti campioni di acque superficiali dall’interno di una diga di un sistema idrico e condizionate secondo quanto previsto dalla norma DIN 37409-60. In particolare i campioni vengono prima filtrati e poi estratti con etanolo. La fase di estrazione è necessaria in quanto l’etanolo inibisce l’attività enzimatica complessiva, arrestando la degradazione della clorofilla operata dalle clorofillasi.
I campioni testati sono stati analizzati con SPECORD 50 PLUS dotato di portacuvette da 50mm, con impostazioni che forniscono prestazioni superiori a quelle richieste dal metodo (1.4nm di fenditura, ±0.003A di precisione fotometrica e ≤ ±0,5 nm di precisione della lunghezza d’onda). L’assorbanza è stata acquisita a 665nm e 750nm.
Per i campioni incogniti è necessario acquisire un primo spettro da 500 a 800nm, per eseguire uno studio sulla concentrazione complessiva e il rapporto di fitopigmenti indagati. Per determinare la clorofilla viene misurata l’assorbanza alle lunghezze d’onda 665 e 750nm. Per determinare e sottrarre il contributo della feofitina viene misurata l’assorbanza prima (Av) e dopo acidificazione (An). Viene quindi definita la concertazione della clorofilla pc, il contributo della feofitina pp e la concentrazione della clorofilla prima dell’acidificazione pg, inoltre si definisce R con rapporto-acido e calcolato sulla base delle assorbanze lette.
Le formule per il calcolo dell’indicatore della clorofilla sono riportate qui di seguito:Determinazione della concentrazione di clorofilla a seguito dell’acidificazione
- Determinazione della concentrazione di clorofilla a seguito dell’acidificazione:
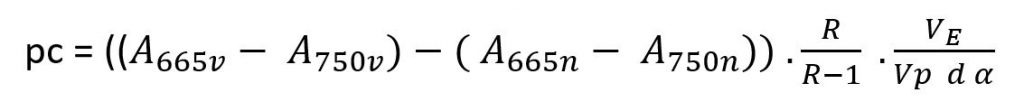
2. Concentrazione di massa della feo-pigmenti:
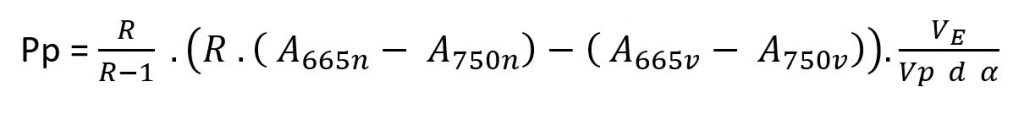
3. Concentrazione di massa della clorofilla prima della correzione con acido:
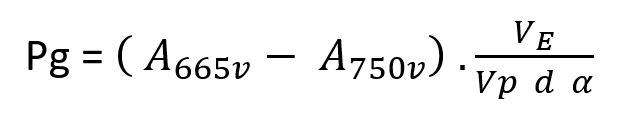
4. Rapporto acido R per convalidare la conformità alla norma DIN 38409-60:
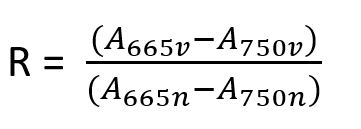
Con le seguenti variabili:
pc Concentrazione di massa della clorofilla espressa in microgrammi/litro
A665v Assorbanza estratta [A] a 665nm prima dell’acidificazione
A750v Assorbanza estratta [A] a 750nm prima dell’acidificazione
A665n Assorbanza estratta [A] a 665nm dopo l’acidificazione
A750n Assorbanza estratta [A] a 750nm dopo l’acidificazione
R Rapporto A665v/A750v per la clorofilla pura, in questo caso R = 1.7
VE Volume estratto in ml
Vp volume di acqua filtrato in litri
d Cammino ottico in cm
α Coefficiente specifico di assorbanza per la clorofilla
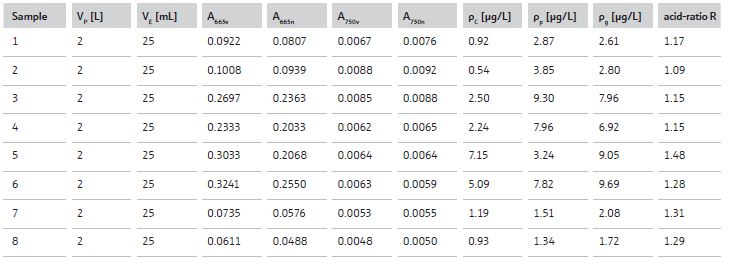
Tutti i dati calcolati sono riportati in Tabella 1.
Risultati
Per comprendere l’uso di questa tecnica spettrofotometrica è importante correlare gli assorbimenti spettrofotometrici con i dettagli strutturali della clorofilla a e b. Queste molecole sono strutturalmente simili, ma nella clorofilla a un gruppo CH3 (metile) è direttamente legato all’anello aromatico, mentre nella clorofilla b la catena laterale metilica è sostituita da un gruppo CHO (acile) (FIGURA 2A).
Nel complesso, l’anello aromatico della clorofilla (a o b) ha un massimo di assorbimento primario nella regione tra 600 e 700 nm. A causa delle differenze strutturali citate, la clorofilla a e la clorofilla b differiscono chiaramente nelle loro caratteristiche proprietà di assorbimento (FIGURA 2B). Secondo la norma DIN 38409-60, il massimo di assorbimento della clorofilla a in etanolo corrisponde all’assorbanza a 665 nm (A665), mentre la clorofilla b ha un massimo più ampio e meno prominente tra 610 e 630 nm con un picco a ca. 620 nm.
L’assorbimento della clorofilla a si sovrappone anche ad altri fitopigmenti (ad es. ficocianobilina), specialmente al di sotto di 650 nm. Questa perturbazione spettrale è debole, ed è quantitativamente soppressa mediante acidificazione. Per questo motivo la misura dell’assorbanza a 665 nm viene effettuata prima (A665v) e dopo (A665n) l’acidificazione. Per compensare il potenziale contributo di altri fitopigmenti, l’assorbanza effettiva viene quindi stimata dalla differenza dell’assorbanza A665 e A750; quest’ultima corrisponde all’assorbanza del campione a 750 nm che dovrebbe essere relativamente bassa. Qui i pigmenti rossi hanno il contributo più importante, ma poiché sono meno solubili in etanolo rispetto alla clorofilla a, forniscono una perturbazione minore. Il valore corretto viene quindi utilizzato per la determinazione quantitativa.
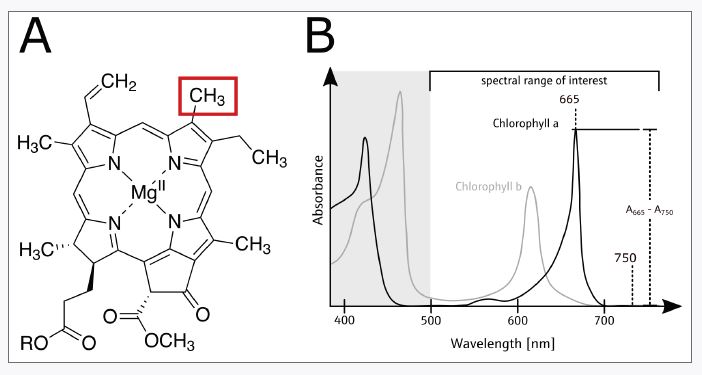
(B) Rappresentazione grafica degli spettri di assorbanza della clorofilla a (nera) e della clorofilla b (grigia), caratteristiche spettroscopiche chiave per determinare la concentrazione di clorofilla a (A665), sono indicati l’assorbanza di fondo (A750) e l’assorbanza con correzione di fondo (A665 – A750).
Conclusioni
Il metodo spettrofotometrico sfrutta le informazioni chiave sullo sviluppo del fitoplancton nelle acque superficiali. Il metodo descritto nella norma DIN 38409-60 fornisce una determinazione rapida e precisa con una procedura di preparazione del campione relativamente semplice.
Inoltre, la facile determinazione spettrofotometrica sfrutta l’accesso a una varietà di componenti (ad esempio, altra clorofilla e carotenoidi, molecole di ficobilina).
A questo proposito, lo SPECORD 50 PLUS offre potenti prestazioni spettroscopiche, accessori adatti per soddisfare i requisiti standard in termini di lunghezze del percorso delle cuvette (50 mm) e un cambia cuvette per una maggiore produttività (cambia cuvette a 6 volte, sia per 10 che 50 mm di lunghezza del percorso).




