Soppressione dei segnali dei solventi protonati e disaccoppiamento del 13C

Tra i sogni di un chimico c’è probabilmente quello di poter disporre di uno strumento analitico veloce e affidabile, che non richieda una lunga preparazione dei campioni e che sia sempre disponibile in laboratorio per l’analisi. L’introduzione dell’NMR da banco nei laboratori ha sicuramente avvicinato gli analisti a questo sogno, è innegabile infatti che strumenti come Spinsolve di Magritek abbiano cambiato l’approccio analitico in molti contesti. Poter disporre di uno strumento piccolo, senza necessità di ambienti dedicati, non distruttivo e con le potenzialità della tecnica NMR è stata una vera svolta epocale. Questi strumenti utilizzano magneti permanenti compatti che non richiedono liquidi criogenici e possono essere di piccole dimensioni per adattarsi al banco del laboratorio tradizionale. Grazie alle misure rapide e semplici, la spettroscopia NMR può essere utilizzata per monitorare processi come reazioni chimiche in presenza di normali solventi. Questa applicazione vuole dimostrare le prestazioni del metodo di soppressione dei solventi WET, sviluppato su uno Spinsolve 80 ULTRA, per attenuare i segnali di alcuni dei solventi organici più comuni. L’elevata stabilità dei sistemi Spinsolve ULTRA consente di attenuare significativamente i picchi dei solventi di due o tre ordini di grandezza, in questo modo la sovrapposizione dei segnali dell’analita e del solvente viene ridotta al punto in cui gli analiti, dopo aver applicato la sequenza WET, possono essere rilevati indipendentemente dalla linea di base.
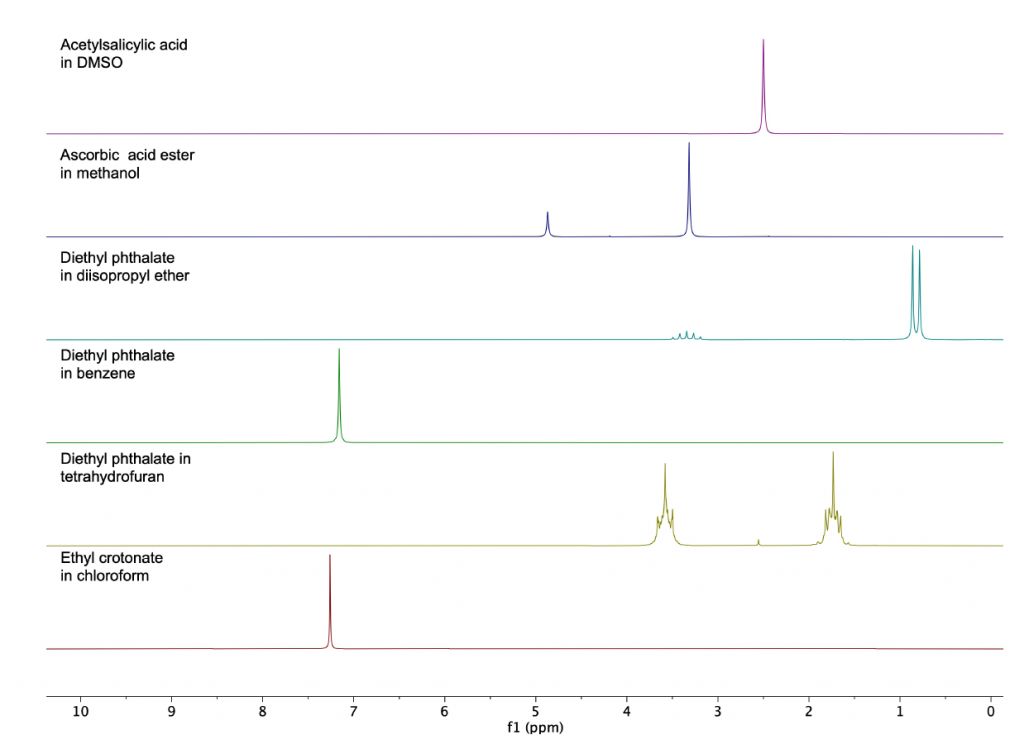
Una delle applicazioni più diffuse per gli spettrometri NMR da banco Spinsolve nei laboratori di chimica è la possibilità di analizzare campioni durante il processo di sintesi. Poiché Spinsolve non richiede solventi deuterati, i campioni possono essere misurati direttamente in solventi protonati senza la necessità di sostituire il solvente. Una limitazione dei solventi protonati è che i segnali tendono a coprire un’ampia zona dello spettro protonico, sovrapponendosi ai segnali dei prodotti disciolti nel campione. Poiché i sistemi NMR da banco funzionano a campi magnetici inferiori rispetto ai magneti superconduttori convenzionali, questa limitazione viene in parte risolta. Una strategia vincente per attenuare i segnali del solvente è l’utilizzo della soppressione del solvente altamente selettiva, come PRESAT o WET, metodi che hanno molto successo con i magneti ad alto campo, ma più difficili da gestire in sistemi da banco perché è necessaria un’elevata stabilità del campo magnetico per ottenere un’efficiente soppressione del solvente. Per risolvere questo problema Magritek ha introdotto la versione ULTRA dei modelli Spinsolve. La superiore stabilità di questi magneti ha potenziato le prestazioni fino al punto in cui i segnali residui dei solventi protonati dopo la soppressione sono diventati paragonabili al segnale dei protoni residui dei solventi deuterati. In questo lavoro sono stati selezionati solventi organici comuni protonati, disciolti alla concentrazione di circa 20 mmol/L. Ogni misura 1D 1H NMR è stata raccolta in un tempo di totale di circa 3 minuti. A causa della grande differenza di concentrazione tra il solvente protonato e gli analiti di interesse, solo i picchi del solvente sono visibili negli spettri (Figura 1).
Tetraidrofurano
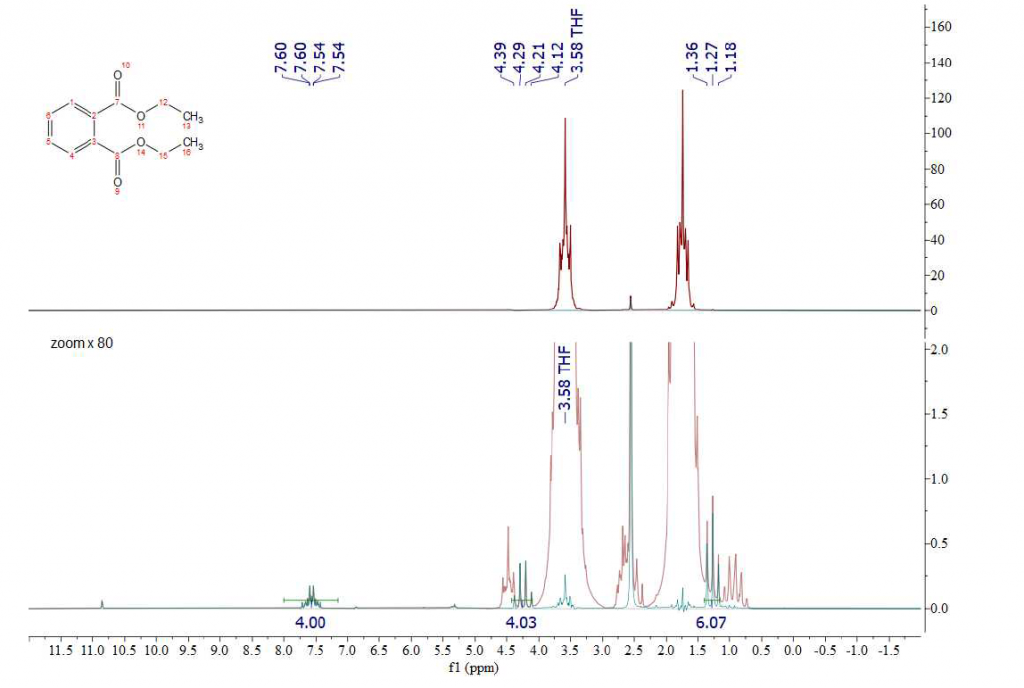
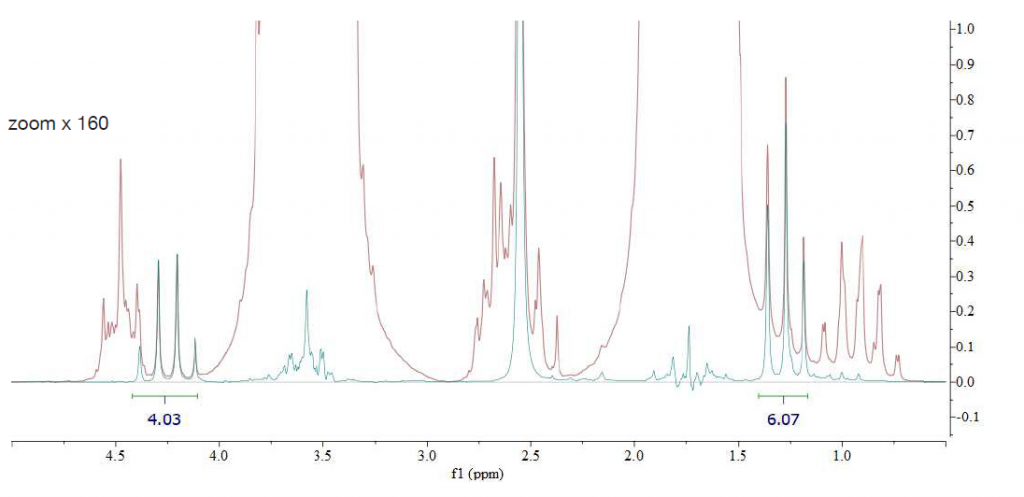
Come primo esempio descriviamo come risulta uno spettro di dietil ftalato nel tetraidrofurano (THF). La Figura 2 mostra lo zoom dello spettro regolato per visualizzare i picchi di interesse. I gruppi simmetrici di estere etilico del dietil ftalato appaiono come un quartetto a 4,25 ppm e un tripletto a 1,27 ppm nella regione alifatica. Ovviamente nessuno di questi gruppi funzionali è chiaramente visibile a causa di una forte sovrapposizione sia con i segnali THF che con i suoi satelliti 13C (spettro rosso). Solo i protoni aromatici a 7,54 ppm sono visibili quando si utilizza il THF protonato come solvente (spettro registrato senza disaccoppiamento del carbonio né soppressione del segnale del solvente).
Benzene
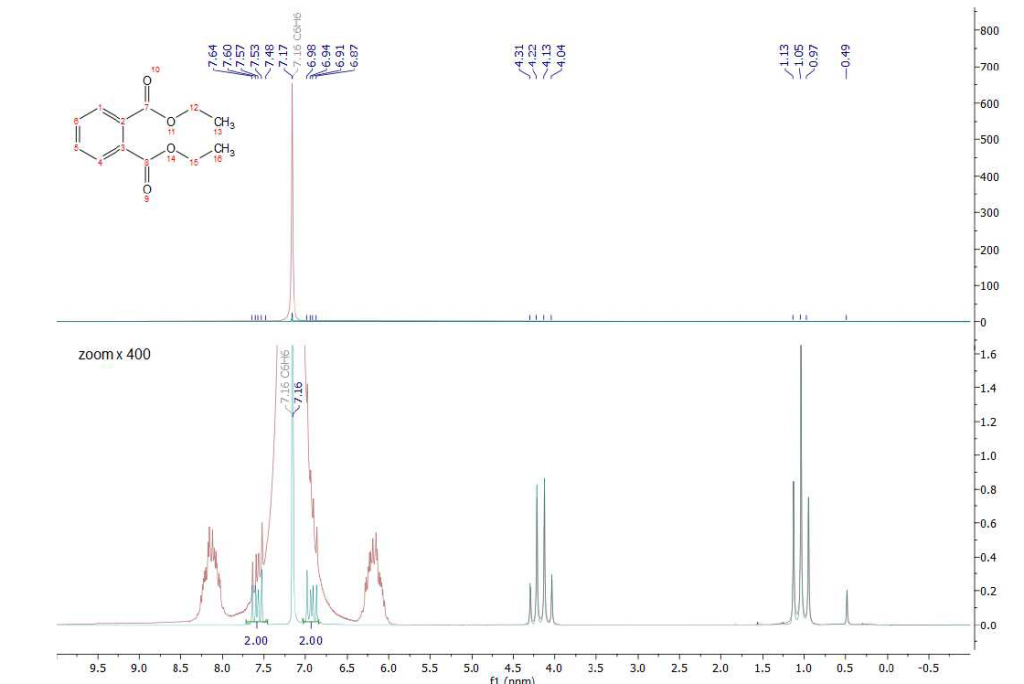
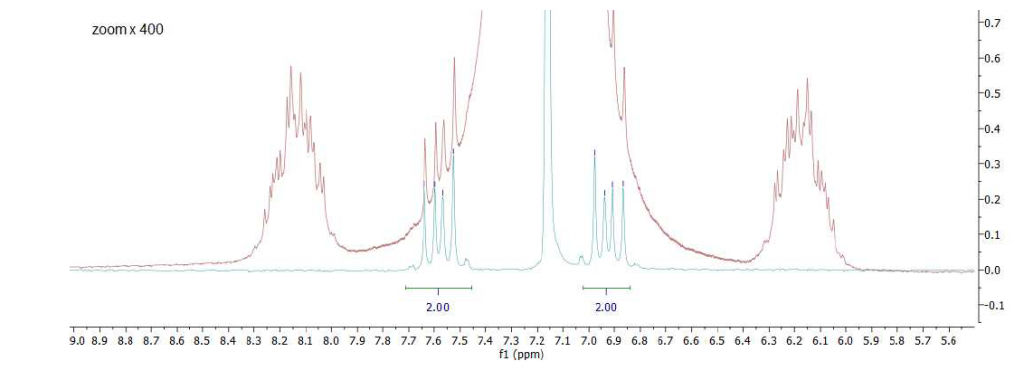
Come secondo esempio valutiamo la possibilità di sciogliere il dietil ftalato in un solvente aromatico, come il benzene. A causa del loro carattere lipofilo, gli ftalati si dissolvono facilmente nei solventi aromatici aprotici. Impiegando il benzene come solvente eliminiamo la sovrapposizione del segnale nella regione alifatica, come osservato sopra nel caso del THF (vedi Figura 2). La difficoltà, in questo caso, è risolvere i segnali dei protoni aromatici del dietil ftalato all’interno della regione aromatica intorno a 7-8 ppm. La Figura 4 mostra un confronto dello spettro 1H standard con lo spettro misurato dopo aver applicato la sequenza di soppressione WET in presenza del disaccoppiamento 13C. Come previsto, la regione alifatica diventa chiara e possono essere identificate entrambe le specie di protoni alifatici a 1,04 ppm e 4,17 ppm. Nello spettro standard (rosso) i protoni aromatici dello ftalato sono completamente coperti dal segnale del benzene a 7,16 ppm. La sequenza WET, applicata con il disaccoppiamento 13C attenua fortemente il segnale del benzene e rimuove completamente i satelliti di carbonio in modo da separare la linea di base dei segnali dello ftalato (spettro ciano). Uno zoom della regione aromatica è mostrato in Fig. 5.
Cloroformio
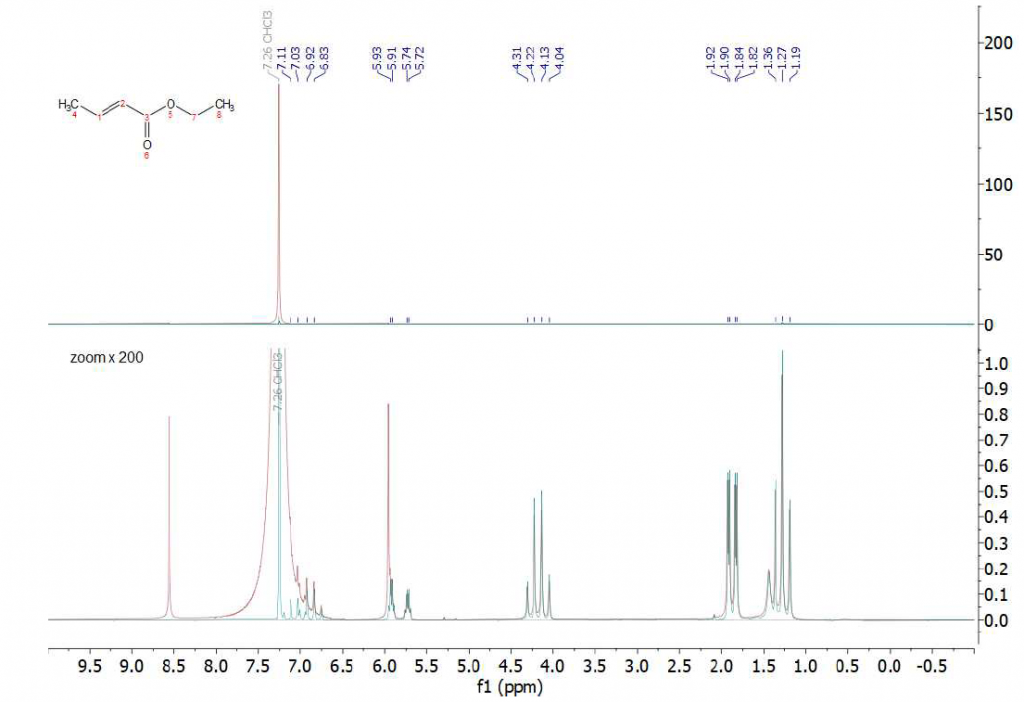
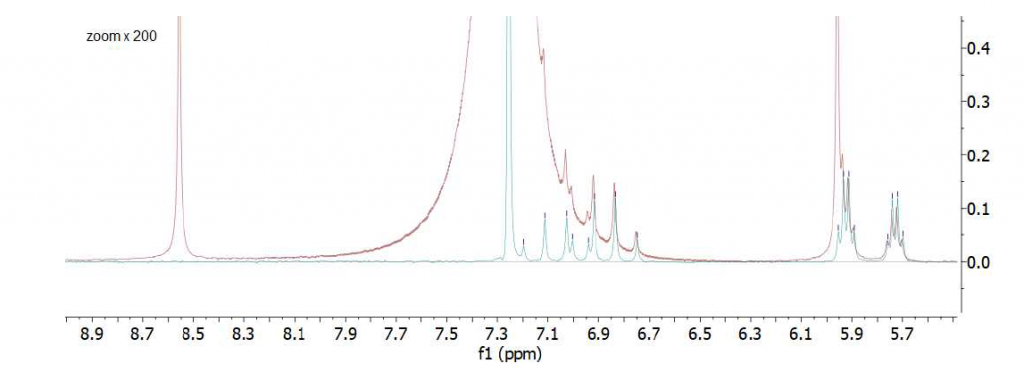
Come terzo esempio, proponiamo lo spettro dell’etil crotonato disciolto in cloroformio protonato ad una concentrazione di 20 mM, registrato con e senza il protocollo di soppressione del solvente WET (Fig. 6). Ancora una volta possiamo osservare come lo spettro registrato con la sequenza WET (spettro ciano) fornisca segnali separati dalla linea di base dei protoni insaturi dell’etil crotonato a 5,83 ppm e 6,97 ppm. Questo esempio mostra chiaramente quanto sia potente la combinazione di un metodo di soppressione del solvente, applicato prima dell’acquisizione del segnale, in presenza di disaccoppiamento del carbonio. In questo esempio, la soppressione WET rimuove la sovrapposizione del picco del solvente principale con i segnali a 6,97 ppm e il disaccoppiamento 13C rimuove i satelliti di carbonio del segnale del solvente sovrapposti al segnale del protone a 5,83 ppm. La selettività ad alta frequenza della sequenza WET per sopprimere il picco del solvente può essere apprezzata dal fatto che il multipletto del protone 1 a 6,97 ppm rimane quasi inalterato nello spettro dopo l’applicazione della sequenza di soppressione del solvente. Uno zoom della regione aromatica è mostrato in Fig. 7.
Metanolo
Questo solvente ha due segnali nella regione alifatica: in un primo esempio abbiamo sciolto tiamina *HCl ad una concentrazione di 20 mMolare. La Figura 8 mostra che nello spettro 1D standard entrambi i segnali del metanolo si sovrappongono in modo significativo ai segnali della tiamina, rendendo impossibile qualsiasi corretta quantificazione dei picchi desiderati nella regione degli alifatici. Dopo aver applicato il protocollo WET e acquisito il segnale in presenza di disaccoppiamento 13C, tutti e quattro i segnali di interesse vengono visualizzati separati dalla linea di base con valori di integrazione corretti. La regione aromatica non è influenzata dal solvente scelto.
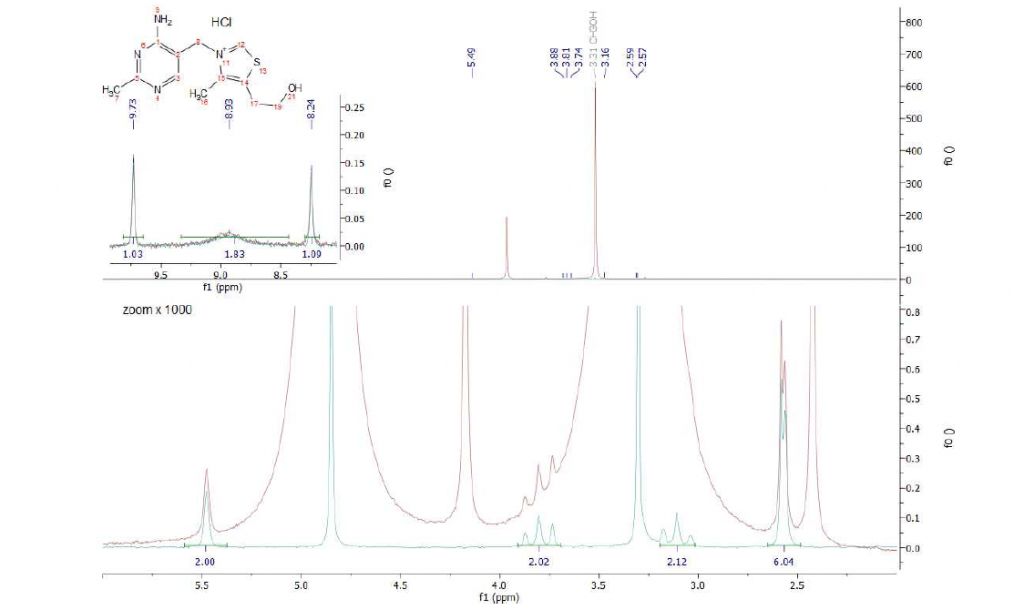
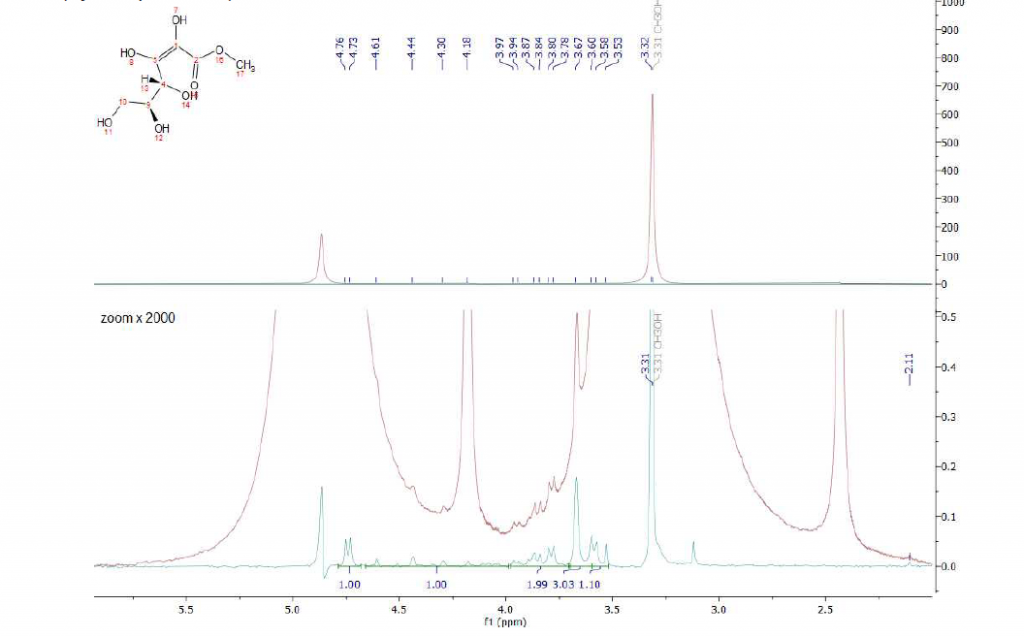
La Figura 9 mostra gli spettri della forma estere aperta dell’acido L-ascorbico in metanolo. L’intera regione alifatica è coperta dai segnali del metanolo e solo dopo aver applicato la sequenza WET, tutti i segnali desiderati possono essere identificati(spettro ciano).
DMSO
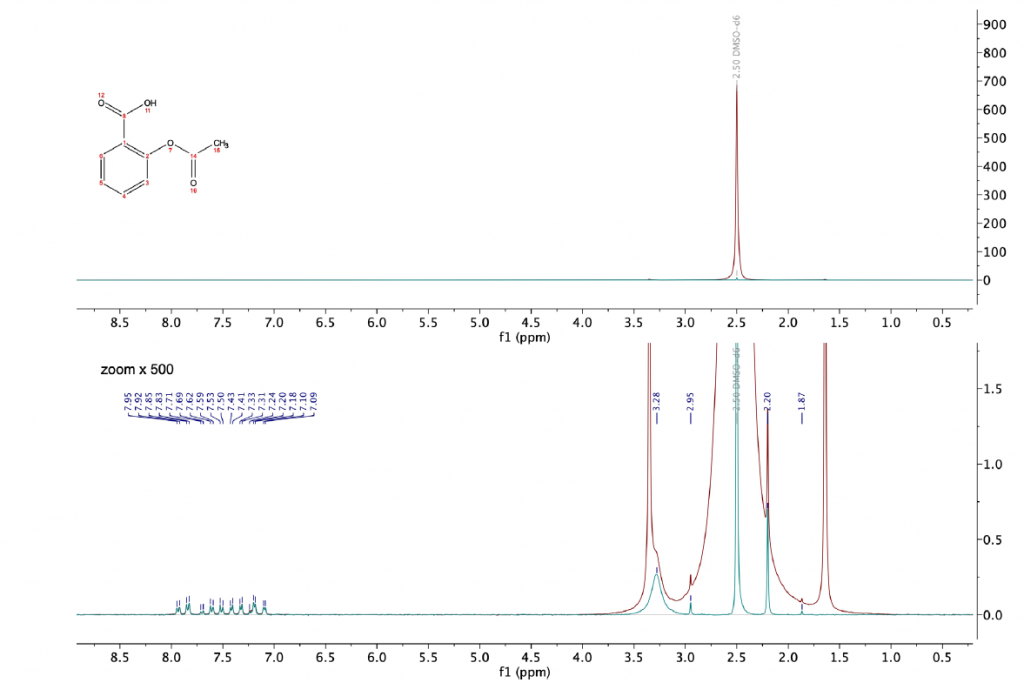
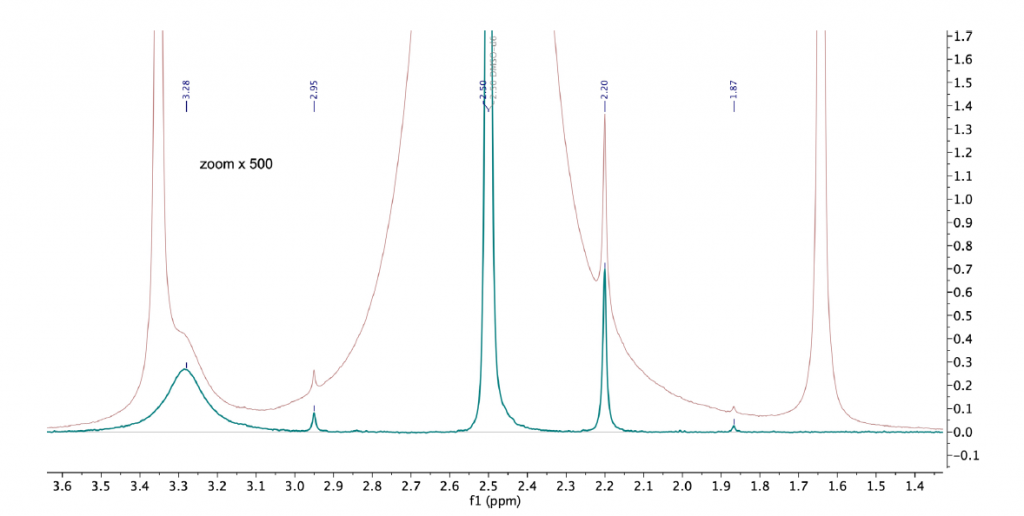
La Figura 10 mostra gli spettri dell’acido acetilsalicilico disciolto in dimetilsolfossido (DMSO). Mentre i protoni della regione aromatica sono completamente risolti a circa 7,50 ppm, il segnale del gruppo metilico proveniente dalla porzione acetilica è visibile solo dopo l’applicazione della sequenza WET per sopprimere il segnale di DMSO a 2,20 ppm.
In sintesi, la sequenza WET che include il disaccoppiamento 13C, implementato sui modelli Spinsolve ULTRA, consente di raccogliere spettri NMR da campioni disciolti in solventi protonati senza richiedere elaborazioni noiose e dispendiose in termini di tempo. Ciò è particolarmente vantaggioso per monitorare le reazioni chimiche online o nelle diverse fasi della sintesi come parte del controllo di qualità del processo.